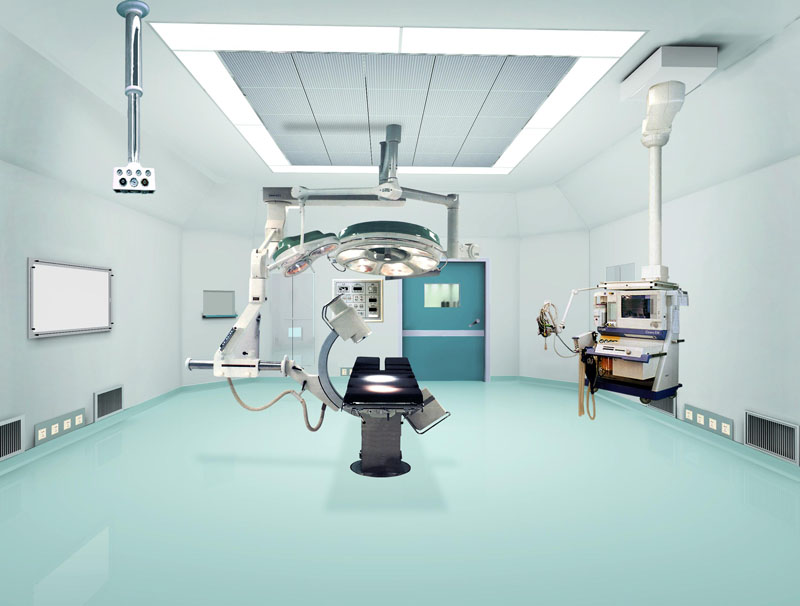
无菌医疗器械洁净厂房部分设置要求
摘要:
广东东莞市卓为机电净化介绍无菌医疗器械洁净厂房中洁净室(区)级别设置原则,以及医疗器械厂房对工作、生产及厂区的环境要求,总体布局的合理性以及洁净生产区生产过程和静压差等要求。
关键词:
医疗器械 洁净厂房 洁净室 洁净区 环境要求 布局 生产区 洁净度级别 设置原则
对工作环境的要求
若有可能对产品质量产生不利影响,应对工作环境条件做出定量或定性的规定
包括从原材料的购进(从提货或运输时)开始;到储存、生产加工过程、监视与测量,以及成品的贮存、运输等,直 到将产品交付给客户为止。
制定环境条件控制程序文件或作业指导书对环境条件的监视和控制
如果环境条件控制是个特殊过程还应对这个过程进行确认。
生产环境要求
厂址选择时应考虑
所在地周围的自然环境和卫生条件良好,至少没有空气或水的污染源,宜远离交通干道、货场等。
厂区的环境要求
厂区的地面、道路应平整不易起尘。宜通过绿化等减少露土面积或有控制扬尘的措施。垃圾、闲置物品等不应露天存放等,总之厂区的环境不应对无菌医疗器械的生产造成污染。
厂区的总体布局合理性
不得对无菌医疗器械的生产区,特别是洁净区有不良影响;人流、物流宜分开。
对新建、扩建的无菌医疗器械生产企业,建议由有医药工业洁净厂房设计资质的单位设计。
洁净生产区
确定在洁净室(区)内生产的过程
分析、识别并确定在洁净室(区)内进行生产的过程,并在相关技术或工艺文件中作出标识。
洁净室(区)的洁净度级别要符合“设置原则”要求。
“设置原则”未能覆盖的或不是单一用途的产品,其环境洁净度级别往产品相似、用途相同或相近上靠,遵循宜高不宜低的原则,就低需要验证。
洁净室(区)静压差要求
不同级别洁净室(区)之间≥5Pa,洁净室(区)与室外≥10Pa
应有压差指示装置。
相同洁净室(区)间压差梯度合理:要求相对高的压差高一些,如果两个过程可能会有一定影响,怕受影响的高一些。
洁净室(区)洁净度级别设置原则
一、采用使污染降至低限度的生产技术,以保证医疗器械不受污染或能有效排除污染。
倡导技术进步,建议用先进的生产技术。
先进的生产工艺、设备、工装和设施等。
在产品形成过程中尽量减少人为因素,尽力地使产品不暴露在操作环境中,尽可能避免人与产品的直接接触。
二、植入和介入到血管内及需要在万级下的局部百级洁净区内进行后续加工(如灌装封等)的器械,不清洗零部件的加工,末道清洗、组装、初包装及其封口,不低于10000级。
植入到血路或心脏内的器械,如:血管支架、心脏瓣膜、人工血管、起博电极、人工动静脉瘘管、血管移植物、体内药物释放导管和心室辅助装置等。
介入到血路内的器械,如:各种血管内导管(如中心静脉导管)、支架输送系统等。
三、植入到人体组织、与血液、骨腔或非自然腔道直接或间接接触器械,(不清洗)零部件的加工、末道清洗、组 装、初包装及其封口等,不低于100000级。
植入到人体组织的器械,如:如起博器、药物给入器械、神经肌肉传感器和刺激器、人工肌腱、乳房植入物、人工喉、骨膜下植入物和结扎夹等。
与血液直接接触的器械,如:血浆分离器、血液过虑器等。
与血路上某一点接触,作为管路向血管系统输入的器械,其特点是间接地通过药液或血液与人体血路接触,如:一次性使用输液器、一次性使用输血器、一次性使用静脉输液针、延长器、转移器等。
主要与骨接触的器械,如:矫形钉、矫形板、人工关节、骨假体、人工骨、骨水泥和骨内器械等。
四、与人体损伤表面和粘膜接触器械,(不清洗)零部件的加工、末道精洗、组装、初包装及其封口,不低于300000级。
与损伤表面(伤口或其他损伤体表)接触器械,如:溃疡、烧伤、肉芽组织敷料或治疗器械、“创可贴”等。
与粘膜或自然腔道接触器械,如:无菌导尿管、无菌气管插管等,其特点是不经穿刺或切开术进入体内的器械。
五、初包装材料生产环境的要求
与无菌医疗器械的使用表面直接接触、不清洗即使用的初包装材料,宜遵循与产品生产环境的洁净度级别相同的原则,使初包装材料的质量满足所包装无菌医疗器械的要求。
如血管内导管、人工乳房、导尿管等的初包装材料。若初包装材料不与无菌医疗器械使用表面直接接触,不低于300000级。
如一次性使用输液器、一次性使用输血器、一次性使用无菌注射器等的初包装材料。
六、对于有要求或无菌加工灌装封,在10 000级下的局部100级洁净区内。
如血管支架的压握、涂药;
血袋生产中抗凝剂、保养液的灌装封;
液体产品的无菌制备和灌装;
以及不能在其容器内进行灭菌的固体产品的无菌处理、传输和包装等。
七、洁净工作服清洗、干燥和穿洁净工作服室、专用工位器具的末道清洗与消毒的区域的空气洁净度级别可低于生产区一个级别。
无菌工作服的清洗可在100000级洁净区内,但灭菌后的整理、贮存应在10000级洁净室(区)内。
洁净工作服的清洗、整理至少为300000级洁净区。